Effects of pore-forming agents on microstructure and properties of biomedical porous Ti/16Mg composites
-
摘要:
采用粉末冶金工艺结合微波烧结法制备了弹性模量接近于人体骨骼、强度符合人体植入物要求的医用多孔Ti/16Mg复合材料。通过扫描电镜、X射线衍射、金相显微镜、压缩试验以及耐腐蚀性测试等手段研究了造孔剂NH4HCO3粒径及添加量(质量分数)对复合材料的微观组织、力学性能和耐腐蚀性能的影响。结果表明:NH4HCO3对多孔Ti/16Mg复合材料的物相组成没有显著影响,试样孔隙随着NH4HCO3粒径的增大而增大,随着NH4HCO3添加量增加,试样孔隙率由16.64%增加到33.09%。当NH4HCO3粒径为165~198 μm、质量分数为18%时,多孔Ti/16Mg试样的弹性模量为6.49 GPa、抗压强度为115 MPa,满足人体植入物的力学性能要求。NH4HCO3粒径对复合材料的耐腐蚀性影响不大,在相同粒径条件下,随NH4HCO3质量分数由0增加至24%,复合材料的耐腐蚀性能略有下降,极化电阻由574.528 Ω·cm‒2下降到139.236 Ω·cm‒2。
Abstract:The biomedical porous Ti/16Mg composite materials with the elastic modulus close to that of human bone and the strength meeting the requirements of human implants were prepared by powder metallurgy combined with microwave sintering method in this paper. The effects of particle size and addition amount (mass fraction) of NH4HCO3 pore-forming agents on the microstructure, mechanical properties, and corrosion resistance of the composites were investigated by scanning electron microscopy, X-ray diffraction, metallography, compression test, and corrosion resistance test. The results show that NH4HCO3 has no significant effect on the phase composition of porous Ti/16Mg composites. The pore size increases with the increase of NH4HCO3 particle size, and the porosity increases from 16.64% to 33.09% with the increase of NH4HCO3 mass fraction. When the particle size of NH4HCO3 is 165~198 μm and the mass fraction is 18%, the elastic modulus of the porous Ti/16Mg composites is 6.49 GPa and the compressive strength is 115 MPa, which can meet the mechanical property requirements of human implants. Particle size of NH4HCO3 has little effect on the corrosion resistance of the porous Ti/16Mg composites. With the same particle size, the corrosion resistance of the porous Ti/16Mg composites decreases slightly and the polarization resistance decreases from 574.528Ω·cm‒2 to 139.236Ω·cm‒2 with the mass fraction of NH4HCO3 increasing from 0 to 24%.
-
钛及钛合金由于优异的力学性能、良好的生物相容性和良好的耐腐蚀性成为当今最具吸引力的生物医用材料之一[1‒2]。然而,骨科手术中植入物的主要问题之一是骨和植入物之间的弹性模量不匹配,一般而言,符合人体骨组织要求的弹性模量为4~30 GPa(钛及其合金为55~110 GPa),抗压强度为10~230 MPa[3‒4],由于不匹配,骨负荷不足,产生“应力屏蔽”[5]。镁合金因具备低模量(~40 GPA)、良好的生物相容和降解性、低密度、低成本等优点,在新兴生物医用材料中备受关注[6]。然而,镁合金在人体环境中的耐腐蚀性较低,其植入物可能会失去支撑骨结构的强度[7]。因此,将钛和镁结合起来,开发低模量、高强度生物医用材料是一种新的思路。将钛镁进行复合,钛提供高强度和高耐腐蚀性,镁提供低模量和一定的生物降解性;二者复合不仅弹性模量会大大降低,而且镁的降解会产生孔隙,有利于成骨细胞的粘附和骨骼与植入物的结合。最近,多孔结构材料也引起了研究者们的广泛关注,因为多孔结构不仅可以为骨骼向内生长提供有利的环境,而且还可以匹配周围骨骼的力学性能(特别是弹性模量和抗压强度),有望减缓“应力屏蔽”作用[8‒9]。
目前常用的生物医用多孔钛及钛合金的制备方法有粉末冶金法、纤维烧结法、铸造法、浆料发泡法、自蔓延高温合成法[10‒11]等。其中,粉末冶金法具有生产工艺简单、流程较短、成本较低等优点,并且通过增加多孔结构可以大幅降低试样的弹性模量。微波烧结作为一种新型烧结技术在粉末材料成形制造领域受到关注[12]。它利用具有特殊波段的微波(频率介于300 MHz~300 GHz、波长介于1 mm~1 m的电磁波[13])与材料基本细微结构耦合从而产生热量,材料在电磁场中产生的介电损耗使其整体加热至烧结温度从而实现致密化[14]。与传统烧结方式相比较,微波烧结具备快速高效、改善材料微观组织、提高材料综合力学性能和节能环保等优点[12,15]。将粉末冶金工艺与微波烧结法进行优势结合制备Ti/Mg复合材料,不仅可使其获得独特的微观结构和性能,而且还能显著减少处理时间、降低烧结活化能[16]等。添加造孔剂可使制备的Ti/Mg复合材料适合人体骨组织生长且具有三维连通孔结构,常用造孔剂包括尿素、碳酸氢铵和硬脂酸等[17‒18]。研究表明,改变NH4HCO3添加量可有效控制多孔复合材料的孔隙率[19]。Wang等[20]通过粉末冶金工艺并添加NH4HCO3造孔剂来制备孔隙率可调的多孔Ti/Mg复合材料,当NH4HCO3质量分数为25%时,复合材料孔隙率在50%左右且抗压强度和弹性模量均与人体骨组织的性能相近。Xiong等[21]采用NH4HCO3为造孔剂,通过粉末冶金法制备出孔隙率为30%~60%、强度和模量分别为112~420 MPa和10.8~33.2 GPa的多孔Ti‒Nb‒Sn合金。梁丹丹等[22]使用粉末冶金工艺制备出孔隙率为4.8%~10.2%、弹性模量为64.46 GPa的Ti‒14Mo合金。王玺涵等[23]将轧制成形与真空烧结相结合制备出多孔Ti‒24Nb‒4Zr‒8Sn材料,当孔隙率为20%~32%时,多孔钛合金压缩强度为140~432 MPa,弹性模量为6~20 GPa。Oliveira等[24]采用粉末冶金法并添加质量分数30%NH4HCO3制备出多孔Ti‒Nb合金,孔隙率在17%~63%,弹性模量在2.6~25.0 GPa。
本课题组前期研究了不同Ti/Mg质量比(镁质量分数8%、12%、16%和20%)对Ti/Mg复合材料性能的影响,发现Ti/16Mg复合材料的性能较为优越,抗压强度为325 MPa,弹性模量为26.69 GPa,维氏硬度为HV 134.32,且具有较好的耐腐蚀性能。研究人员分析了NH4HCO3造孔剂对粉末冶金多孔钛[25]、多孔Ti‒Nb‒Sn合金[26‒27]、多孔Ti‒Nb‒Zr合金[28]和多孔Ni‒Ti形状记忆合金[29]等材料性能的影响。然而,关于造孔剂粒径与添加量对钛及其合金性能影响的系统研究较少。本文以Ti/16Mg复合材料为基体材料,NH4HCO3为造孔剂,采用粉末冶金工艺结合微波烧结法制备了多孔Ti/16Mg复合材料,研究了NH4HCO3造孔剂粒径和添加量(质量分数)对多孔Ti/16Mg复合材料微观组织、力学性能和耐腐蚀性能的影响。
1. 实验材料及方法
1.1 实验原料
原料钛粉(纯度≥99.9%,粒度≤48 μm)、镁粉(纯度≥99.9%,粒度≤74 μm)购于北京研邦新材料科技有限公司,碳酸氢铵(纯度≥99.9%)购于阿拉丁试剂有限公司,钛、镁粉末中其他化学成分见表1所示,原始粉末微观形貌如图1所示。
表 1 钛、镁粉末中元素化学成分(质量分数)Table 1. Chemical composition of the Ti and Mg powders% 粉末 Fe Al C N Si V Mn Cu Cl Ni Pb Ti粉 ≤0.02 ≤0.01 ≤0.01 ≤0.01 ≤0.01 ≤0.02 ≤0.01 — — — — Mg粉 ≤0.02 ≤0.02 — — ≤0.01 — ≤0.01 ≤0.01 ≤0.01 ≤0.01 ≤0.01 1.2 实验方法
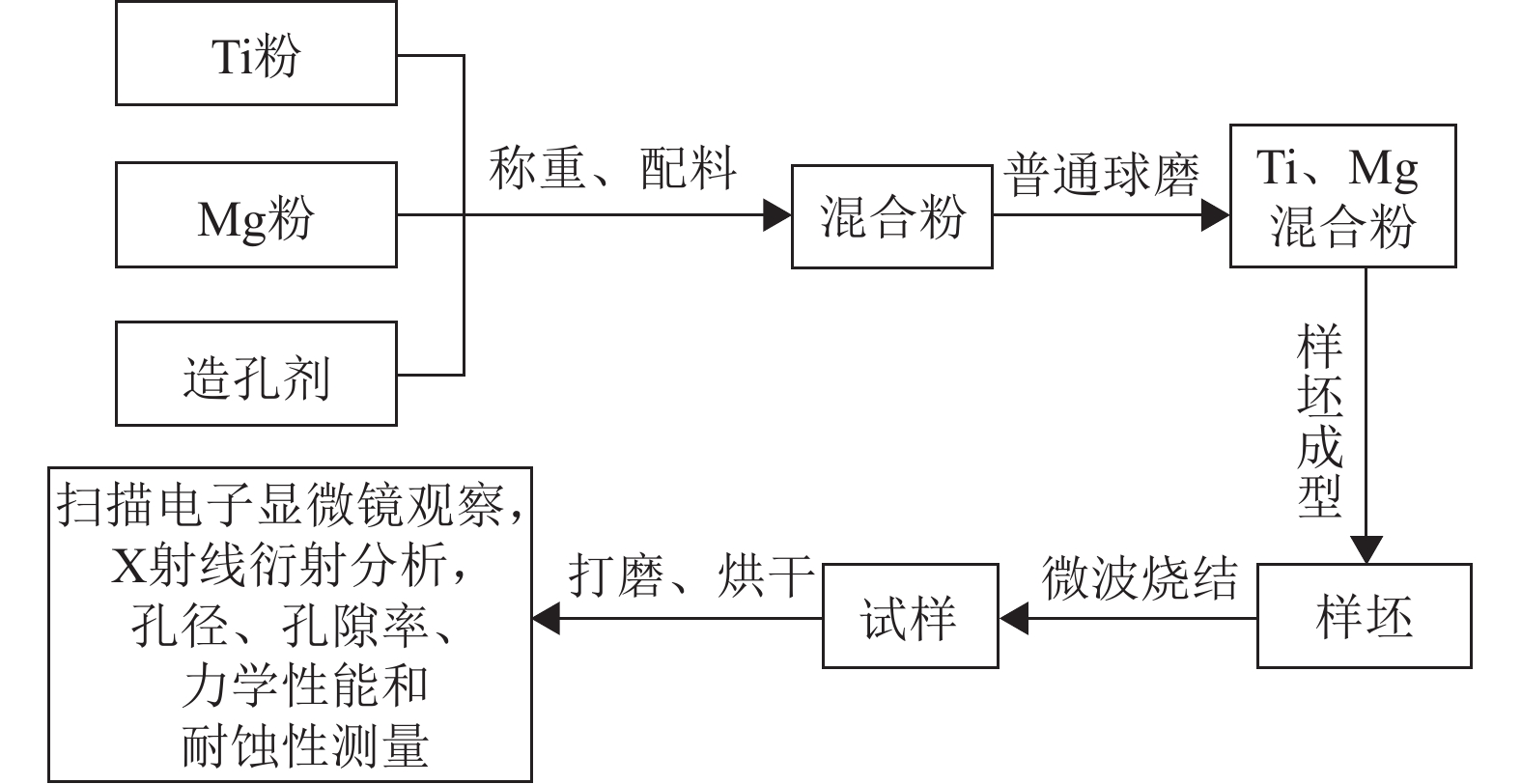
使用FA2104A型电子天平将纯钛粉、纯镁粉按照Ti/16Mg(镁质量分数16%)进行称量,将称量后的合金粉末放入不锈钢球磨罐中,向球磨罐中加入罐体体积1/3的正己烷作助研剂。按照球料比为10:1向球磨罐中加入不锈钢磨球,然后分次加入不同添加量(6%、12%、18%、24%,质量分数)NH4HCO3造孔剂。由于钛、镁粉末化学性质活泼,易发生氧化反应,因此上述操作均在高纯氩气环境下的手套箱中进行。将密封后的球磨罐放置在ZQM-4L型行星式球磨机(长沙米淇仪器设备有限公司)中进行球磨混粉,为防止球磨过程中过热导致实验室事故,每运行30 min暂停5 min,球磨时间为8 h。为了避免球磨后混合粉末的氧化,需要在氩气手套箱中取出球磨罐中的混合粉末。将球磨后含有正己烷的混合粉末放在烧杯中静置一段时间,倒掉上层清液,将装有湿润混合粉末的烧杯快速放入真空干燥箱中,在抽真空处理后55 ℃下烘干6 h,得到干燥、流动性较好的Ti/16Mg混合粉末,实验流程见图2所示。
球磨完成后称取一定质量的混合粉末放入钨钢模具中,使用WDW-200型万能压力试验机在550 MPa的单向压力下将混合粉末压制成型,压制速度为6.366 MPa·s‒1,保压时间为200 s,制成厚度为1 mm的片状和高度为10 mm的柱状坯体。将压制成型后的待烧结坯体放入真空干燥箱中,在80 ℃条件下保温10 h去除NH4HCO3,得到待烧结多孔复合材料。将待烧结多孔复合材料放入WBMW-JS4型微波气氛烧结炉中在高纯氩气保护下进行烧结,烧结温度为600 ℃,升温速率为30℃·min‒1,保温20 min,随炉冷却。
1.3 表征及测试
使用180#~2000#砂纸磨抛烧结试样。采用德国布鲁克AXS公司D8 ADVANCE型小角X射线衍射仪(X-ray diffraction,XRD)分析试样物相,2θ为10°~80°,扫描速度为10°·min‒1。利用日本日立株式会社S-
4800 型场发射扫描电子显微镜(scanning electron microscopy,SEM)观察Ti/16Mg复合材料微观形貌,并利用其自带的能谱仪(energy disperse spectroscope,EDS)对复合材料进行面扫描和点扫描分析。通过WDW-200型电子万能试验机测试圆柱型试样(高度为10 mm、直径为10 mm)常温力学性能,绘制压缩应力‒应变曲线,通过计算得到复合材料的弹性模量及抗压强度[30]。采用阿基米德排水法测量和计算复合材料相对密度和孔隙率[31],Ti/16Mg复合材料的理论密度值为3.59 g·cm‒3,理论密度(ρ0)可根据式(1)获得。$$ {\rho }_{{0}}=\frac{1}{\dfrac{{\omega }_{(钛)}}{{\rho }_{钛}}+\dfrac{{\omega }_{(镁)}}{{\rho }_{镁}}} $$ (1) 式中:ω(钛)为复合材料中钛粉的质量分数,%;ω(镁)为复合材料中镁粉的质量分数,%;ρ镁为镁粉的理论密度,g·cm‒3;ρ钛为钛粉的理论密度,g·cm‒3。
通过Princeton Versa STAT 4电化学工作站测试试样的动电位极化曲线,表征复合材料在人体模拟液中的耐腐蚀性能[32]。采用三电极体系绘制Tafel曲线,获得试样的极化曲线斜率、自腐蚀电流(Icorr)以及自腐蚀电位(Ecorr),通过式(2)计算腐蚀电阻(Rp)[33]。人体模拟体液配方如表2所示,其中HCl浓度为1 mol/L,用量为39 mL。
表 2 人体模拟液配方Table 2. Formula of the simulated body fluidg·L‒1 NaCl NaHCO3 KCl K2HPO4·3H2O MgCl2·6H2O CaCl2 Na2SO4 (CH2OH)3CNH2 8.035 0.355 0.255 0.231 0.311 0.292 0.072 6.118 $$ R_{\text{p}} = \frac{{\beta _{\mathrm{a}}\left| {\beta _{\mathrm{c}}} \right|}}{{2.303\left( {\beta _{\mathrm{a}} + \left| {\beta _{\mathrm{c}}} \right|} \right)I_{\mathrm{corr}}}} $$ (2) 式中:βa为阳极极化斜率;βc为阴极极化斜率;Icorr为自腐蚀电流,A·cm‒2。
2. 结果与讨论
2.1 造孔剂对多孔Ti/16Mg复合材料微观组织的影响
2.1.1 造孔剂粒径对多孔Ti/16Mg复合材料微观组织的影响
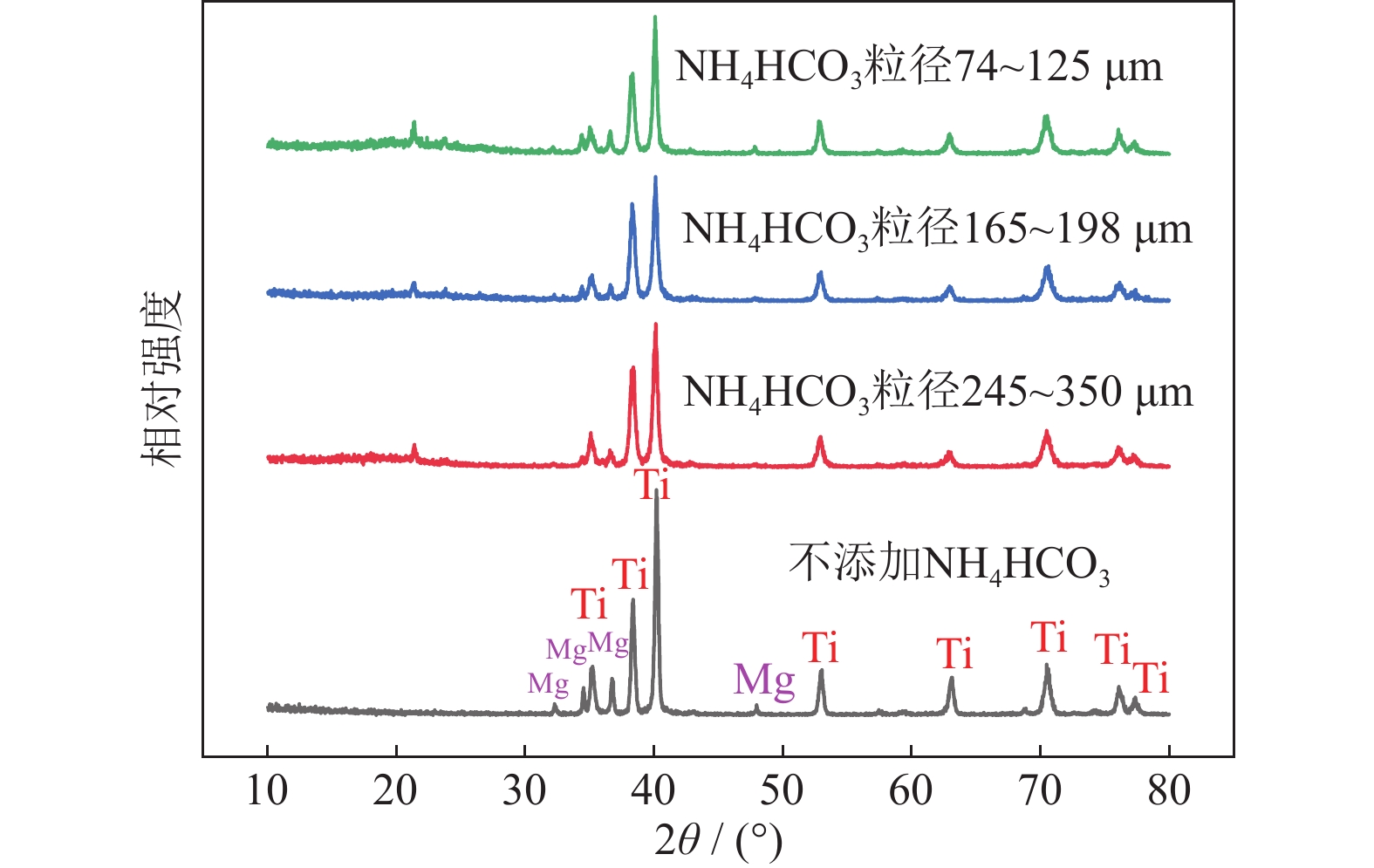
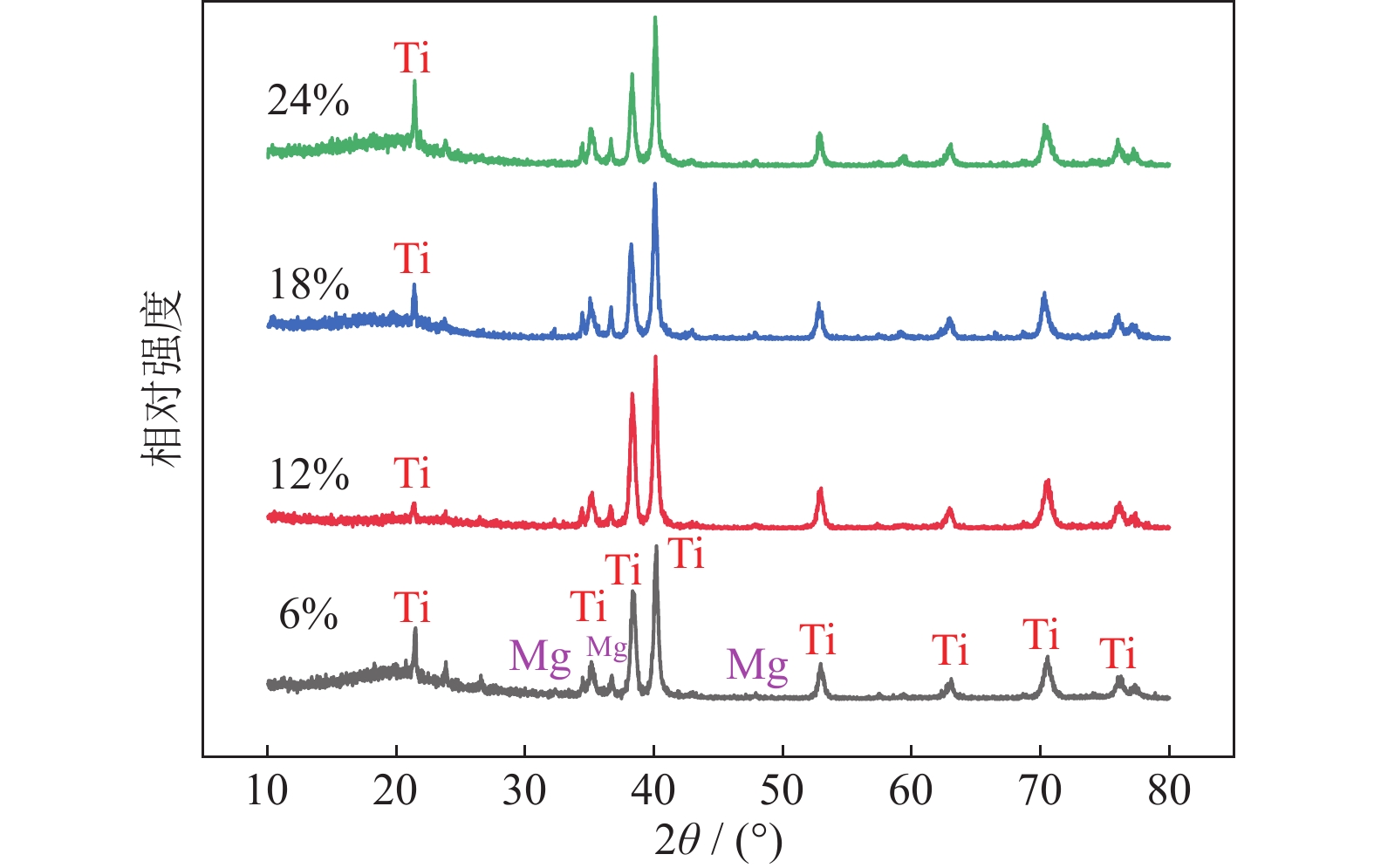
图3为添加不同粒径18%NH4HCO3制备的Ti/16Mg复合材料X射线衍射图。从图中可以看出,不添加NH4HCO3和添加NH4HCO3试样都只有钛镁衍射峰,添加不同粒径NH4HCO3试样中没有新相产生,这是因为NH4HCO3在烧结前已被充分脱除。
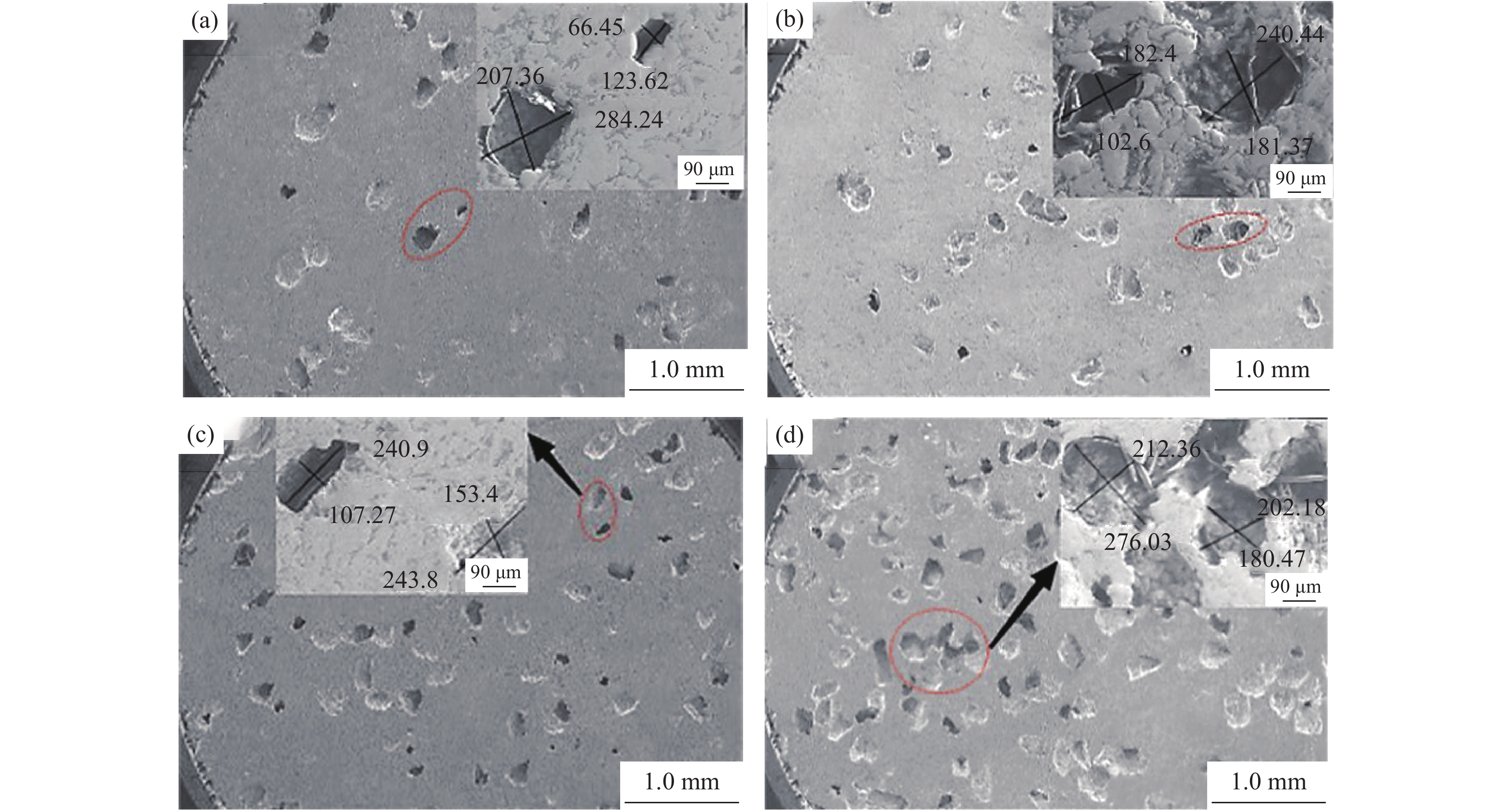
图4为添加不同粒径18%NH4HCO3制备的多孔Ti/16Mg复合材料显微形貌。由图4可知,在复合材料制备过程中加入NH4HCO3造孔剂,经过烧结磨抛之后,多孔Ti/16Mg复合材料表面出现深、浅两种椭圆形孔洞。NH4HCO3粒径为245~350 μm,多孔Ti/16Mg复合材料内部产生的孔洞孔径为243~430 μm;NH4HCO3粒径为165~198 μm,多孔Ti/16Mg复合材料内部产生的孔洞孔径为107~244 μm;NH4HCO3粒径为74~125 μm,多孔Ti/16Mg复合材料内部产生的孔洞孔径为47~150 μm。由此说明,试样孔径大小随着造孔剂NH4HCO3粒径的减小而减小。研究表明,孔径大小在100~500 μm的连通孔结构有利于骨长入[11,34],因此实验采用粒径为245~350 μm和165~198 μm的NH4HCO3制备出的多孔复合材料满足多孔植入体对骨组织长入的孔径要求[35]。
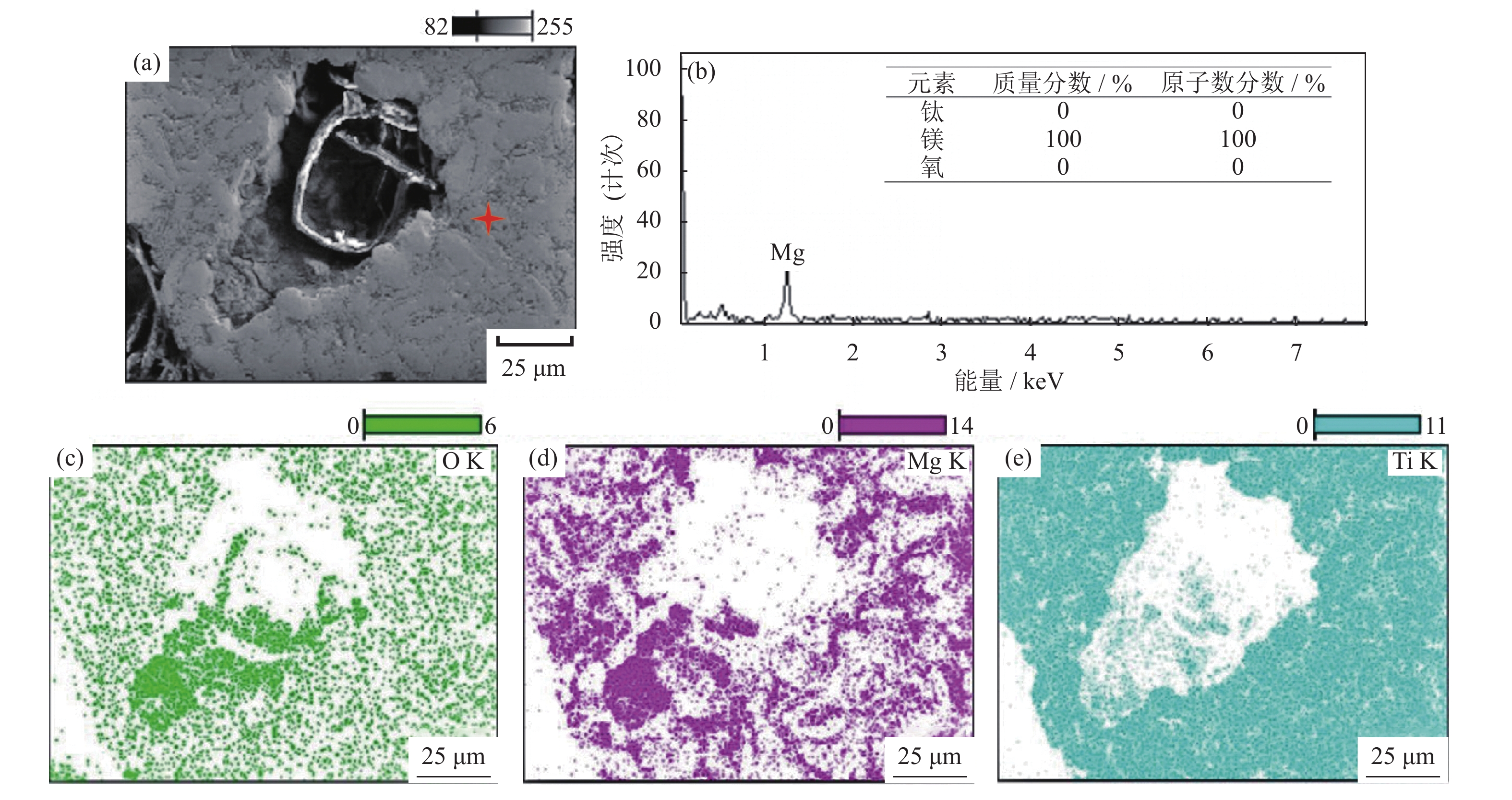
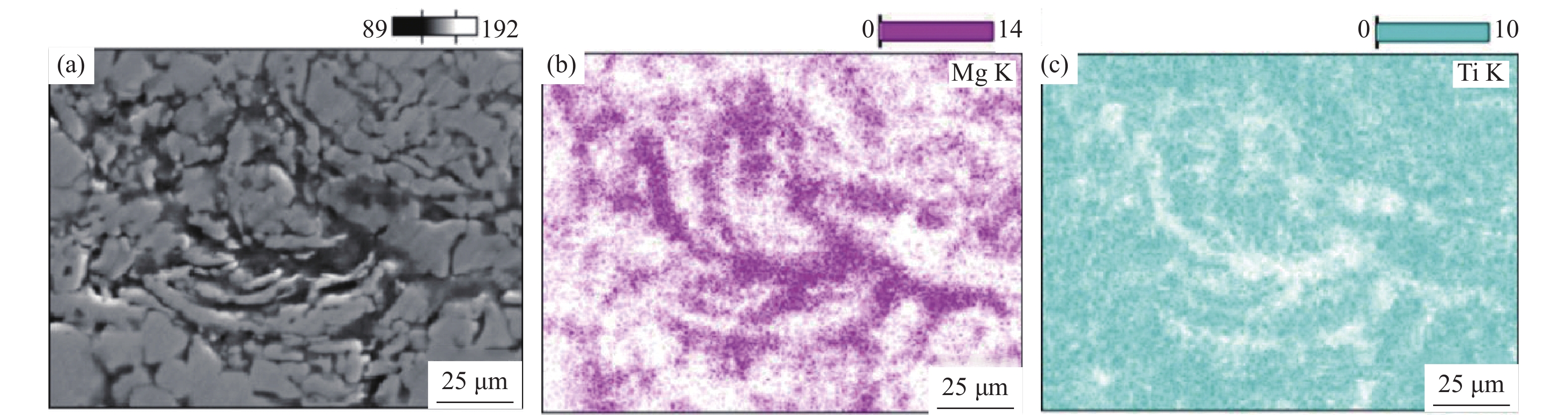
图5为多孔Ti/16Mg复合材料孔隙周边面扫图和点扫图。由图可知,在多孔Ti/16Mg复合材料孔隙周边能够检测到Mg、Ti和O三种元素,O元素和Mg元素的分布相似,说明多孔Ti/16Mg复合材料中主要是镁相发生了氧化。同时发现在孔隙附近O元素分布较为密集,而距离孔隙越远,O元素分布较为疏松,说明镁相的氧化主要发生在多孔复合材料孔隙附近。结合图6可知,在多孔复合材料非孔隙部位的扫描结果显示没有氧元素,基本没有发生氧化。原因是在试样坯体放入真空干燥箱内80 ℃干燥时,造孔剂NH4HCO3分解产生大量H2O、CO2和NH3,大量气体逸散在真空干燥箱内,少量H2O和CO2气体吸附在孔隙内部,在微波烧结脱脂阶段,吸附在孔隙内部的少量H2O和CO2与镁反应生成了氧化镁。
2.1.2 造孔剂添加量(质量分数)对多孔Ti/16Mg复合材料微观组织的影响
图7为添加不同质量分数NH4HCO3(粒径165~198 μm)制备的Ti/16Mg复合材料X射线衍射图谱。如图所示,随着NH4HCO3质量分数的提高,Ti/16Mg复合材料的X射线衍射谱没有明显变化,即物相没有明显变化。图8为对应的复合材料显微形貌。随着NH4HCO3质量分数的提高,多孔Ti/16Mg复合材料的孔径大小没有明显变化,一般在100~300 μm范围内,但孔洞数量明显增多,组织内部逐渐呈现贯通的趋势。
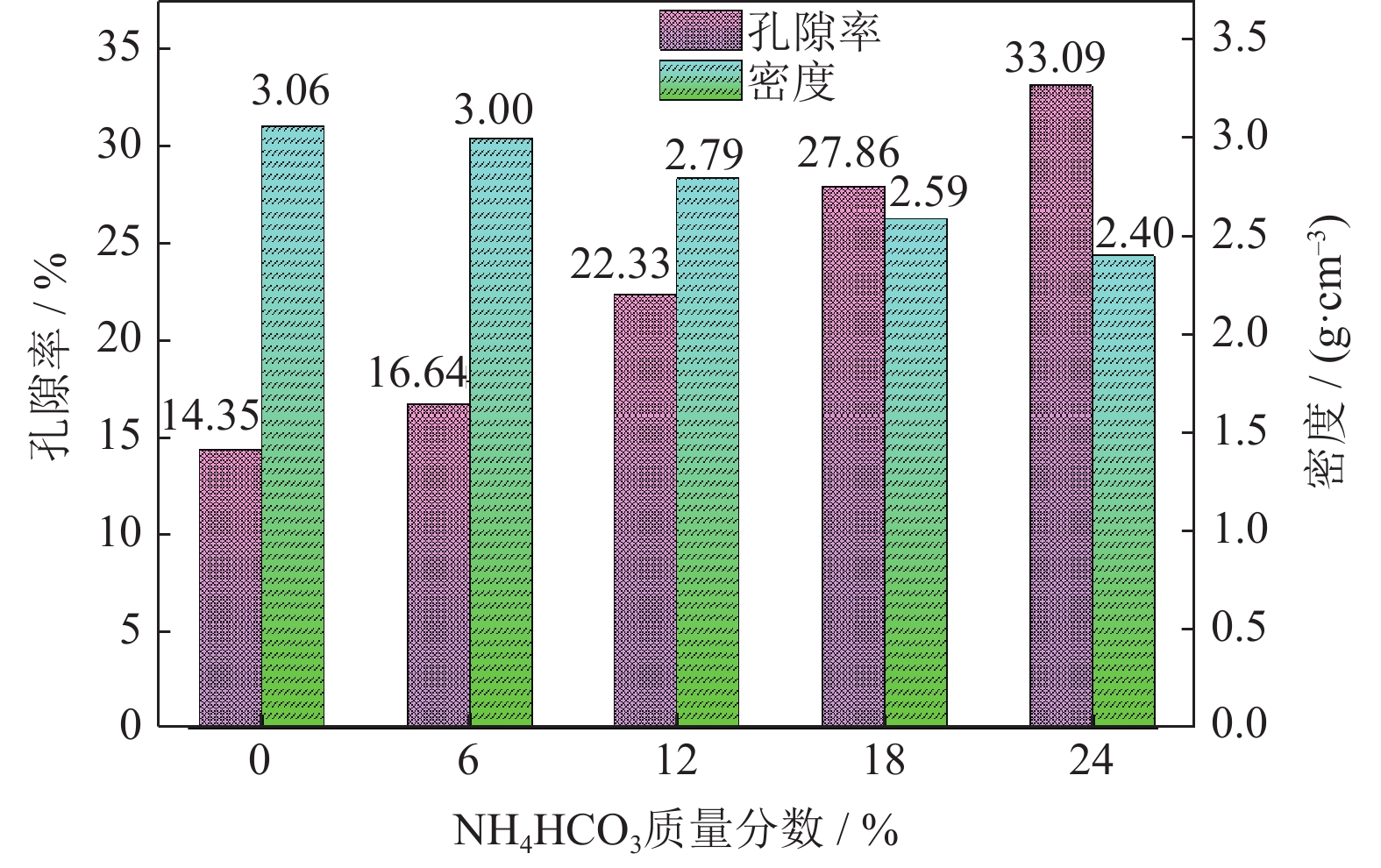
图9为添加不同质量分数NH4HCO3(粒径165~198 μm)制备的Ti/16Mg复合材料密度和孔隙率。由图可知,多孔Ti/16Mg复合材料的孔隙率随着NH4HCO3添加量的增加而逐渐增大。当不添加NH4HCO3时,Ti/16Mg复合材料的孔隙率为14.35%,产生孔隙的主要原因是在压制成型过程中Ti粉、Mg粉之间存在一定孔隙,虽然烧结后有致密化,但还是存在孔隙。当NH4HCO3添加量分别为6%、12%,18%和24%时,试样孔隙率分别为16.64%、22.33%、27.86%和33.09%,孔隙率逐渐变大,其原因不仅是Ti粉、Mg粉颗粒之间的间隙,而是由NH4HCO3大量分解形成的孔隙,NH4HCO3添加量越高,其受热分解形成的孔隙越多,孔隙率越大。用于新骨组织向内生长的植入材料的最佳孔隙率在20%~50%,由上述分析可知,NH4HCO3的添加量为18%时,孔隙率为27.86%,适合人体植入物生长,复合材料的密度为2.59 g·cm‒3,与人体骨骼的密度(1.8~2.1 g·cm‒3)[36]也相近。
综上所述,添加造孔剂NH4HCO3后,无论是改变粒径还是改变添加量,多孔Ti/16Mg复合材料都没有产生新的物相;除此之外,NH4HCO3分解产物均不会和主相发生反应,说明在球磨混粉及随后的烧结过程中,合金中仍以Ti和Mg元素为主。当NH4HCO3粒径由245~350 μm减小到74~125 μm,多孔Ti/16Mg复合材料的密度和孔隙率变化幅度均小于1%;不同粒径NH4HCO3制备出的复合材料孔隙大小不一样,但是孔隙率接近,约为33%,说明NH4HCO3粒径的变化不会导致多孔Ti/16Mg复合材料密度和孔隙率产生明显变化。当NH4HCO3质量分数由6%增加到24%,多孔Ti/16Mg复合材料的孔隙率由16.64%增大至33.09%,增大幅度为98.86%,密度由3.00 g·cm‒3下降到2.40 g·cm‒3,说明NH4HCO3的添加量影响多孔Ti/16Mg复合材料的孔隙数量,通过控制复合材料的孔隙数量可以调控孔隙率的大小。
2.2 造孔剂对多孔Ti/16Mg复合材料力学性能的影响
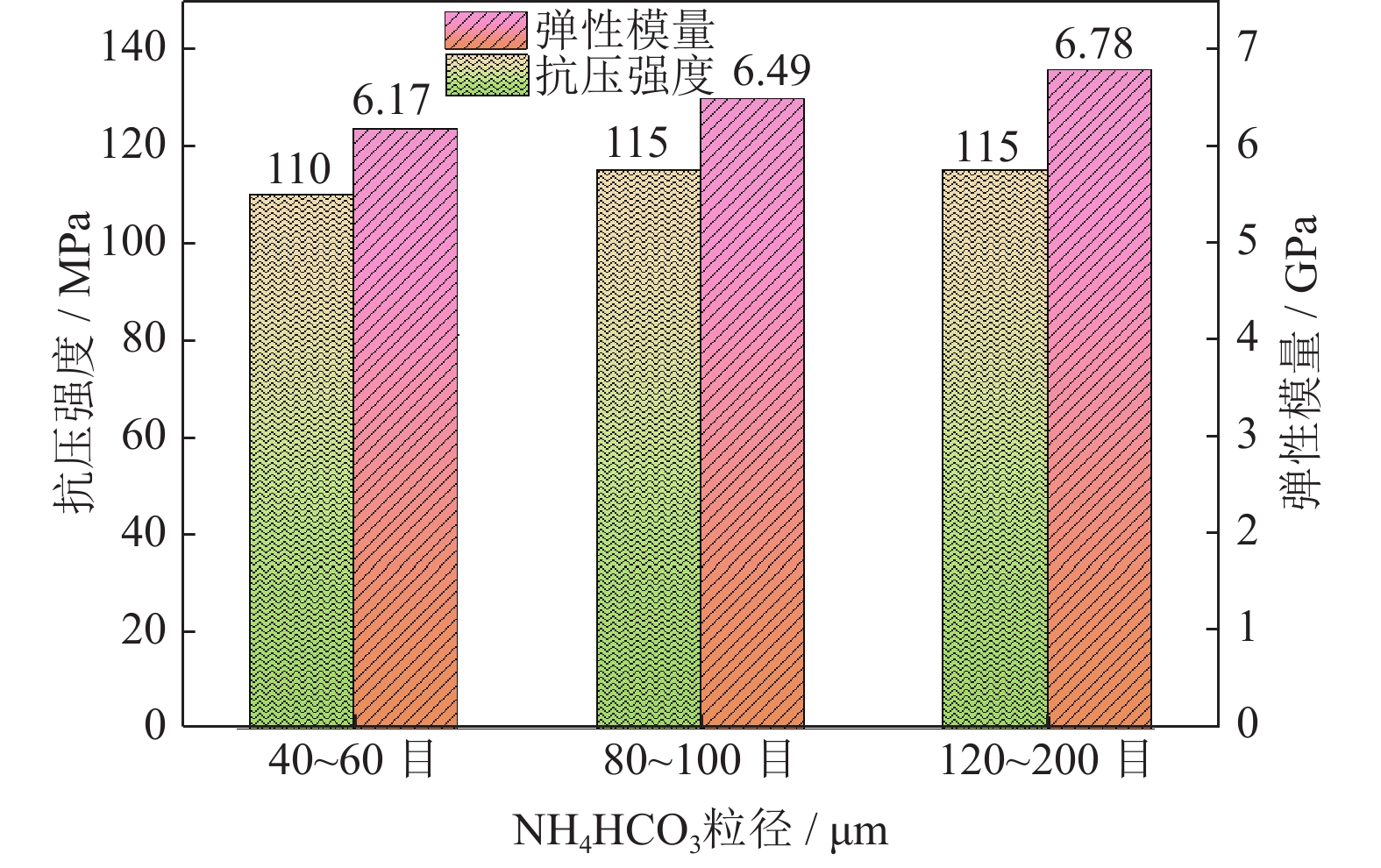
2.2.1 造孔剂粒径对多孔Ti/16Mg复合材料力学性能的影响
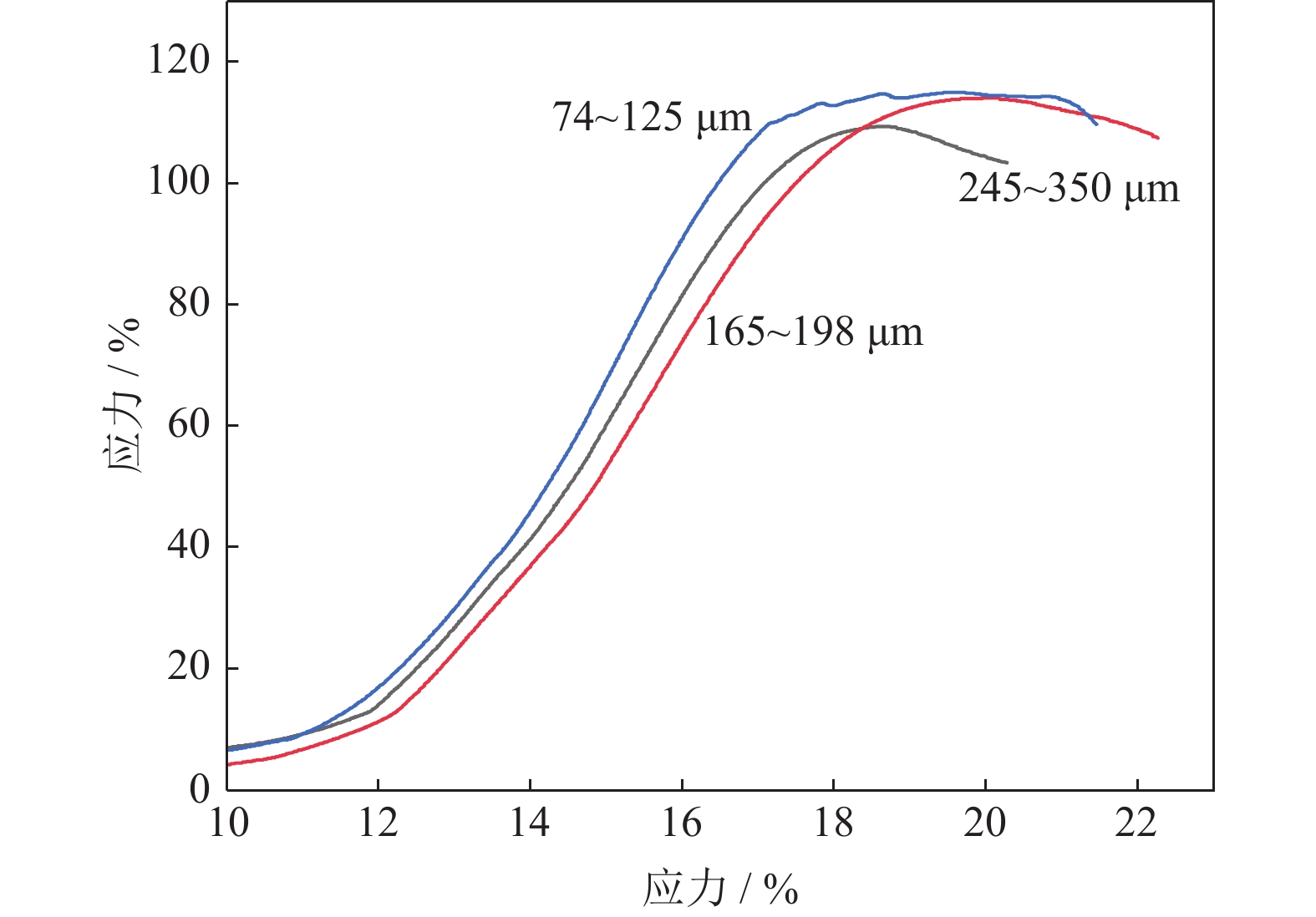
图10为添加不同粒径18%NH4HCO3制备的多孔Ti/16Mg复合材料的应力应变曲线。由图可以看出,Ti/16Mg试样在压缩变形过程中首先经过斜率较小的弹性变形,随后是塑性变形阶段,出现屈服平台点到达试样可承受应力最大值,最后由于试样内部孔壁塌陷,发生断裂[37]。由图10应力应变曲线最高点处的压缩强度和弹性变形阶段的斜率得到图11所示不同粒径下压缩强度和弹性模量。由图11可知,在NH4HCO3添加量一定时,孔径为245~350、165~198和74~125 μm时,根据胡克定律,材料的应力和应变成正比例关系,其比例系数即为弹性模量[38],弹性模量值分别为6.17、6.49和6.78 GPa,抗压强度分别为110、115和115 MPa。由此说明,不同粒径NH4HCO3对复合材料的弹性模量和抗压强度影响很小。
2.2.2 造孔剂添加量(质量分数)对多孔Ti/16Mg复合材料力学性能的影响
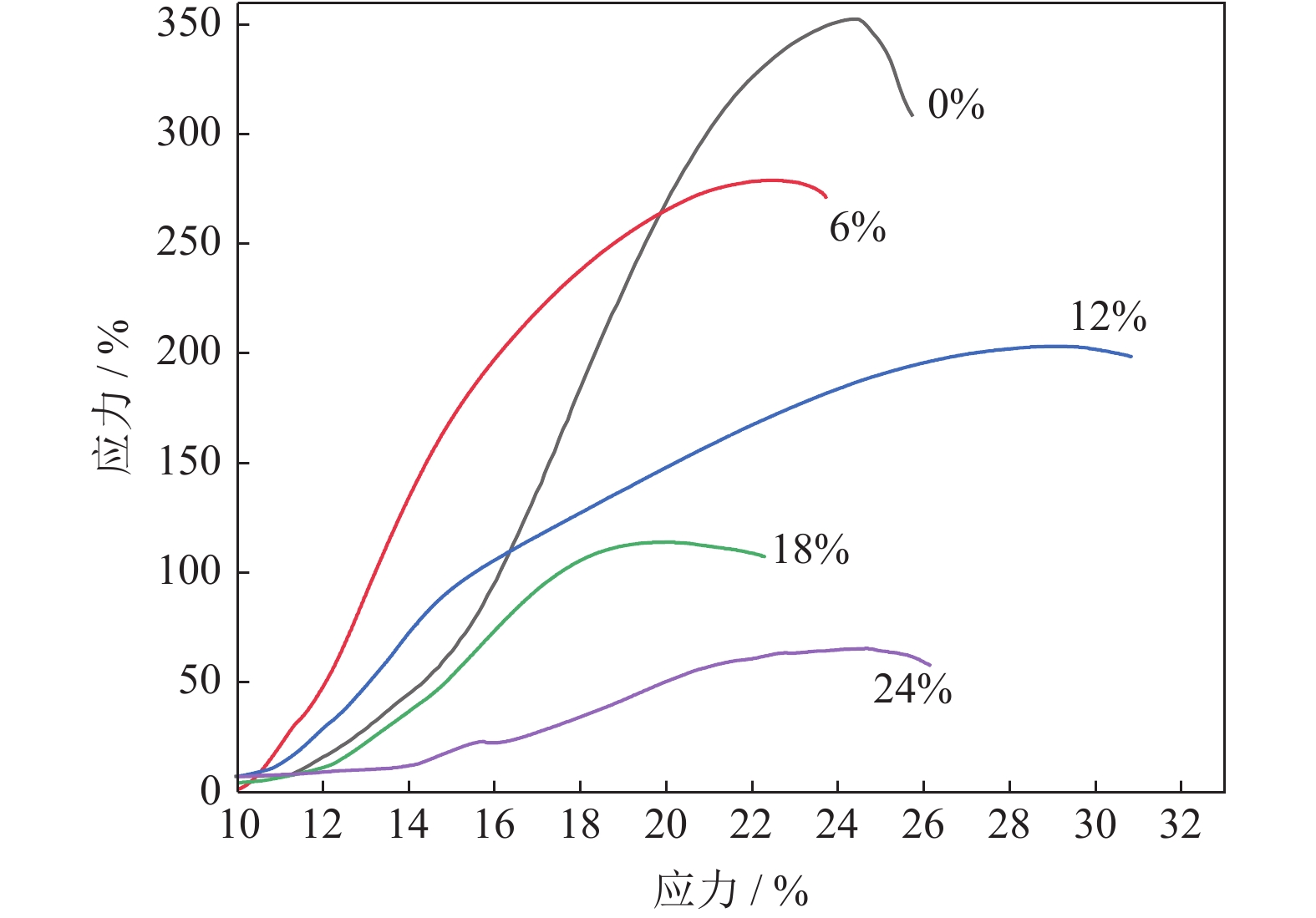
图12为添加不同质量分数NH4HCO3(粒径165~198 μm)制备的多孔Ti/16Mg复合材料应力应变曲线。由图12可知,随着NH4HCO3添加量的增加,多孔Ti/16Mg复合材料的应力应变曲线形状变化较大。当NH4HCO3质量分数由0增大到24%时,结合图9和图13可知,孔隙率逐渐增大,由14.35%增大到33.09%,弹性模量由29.21 GPa降低到4.70 GPa,有效降低了植入物的弹性模量,使其与人体硬组织更加匹配。此外,在应力应变曲线中并没有发现明显的应力压缩平台变形,当压缩应力达到最大值时,脆性破坏不会立即发生,而是在由多孔结构引起的低应力下继续变形,较高的孔隙率导致高应力转变为低应力,从而发生较大的应变。
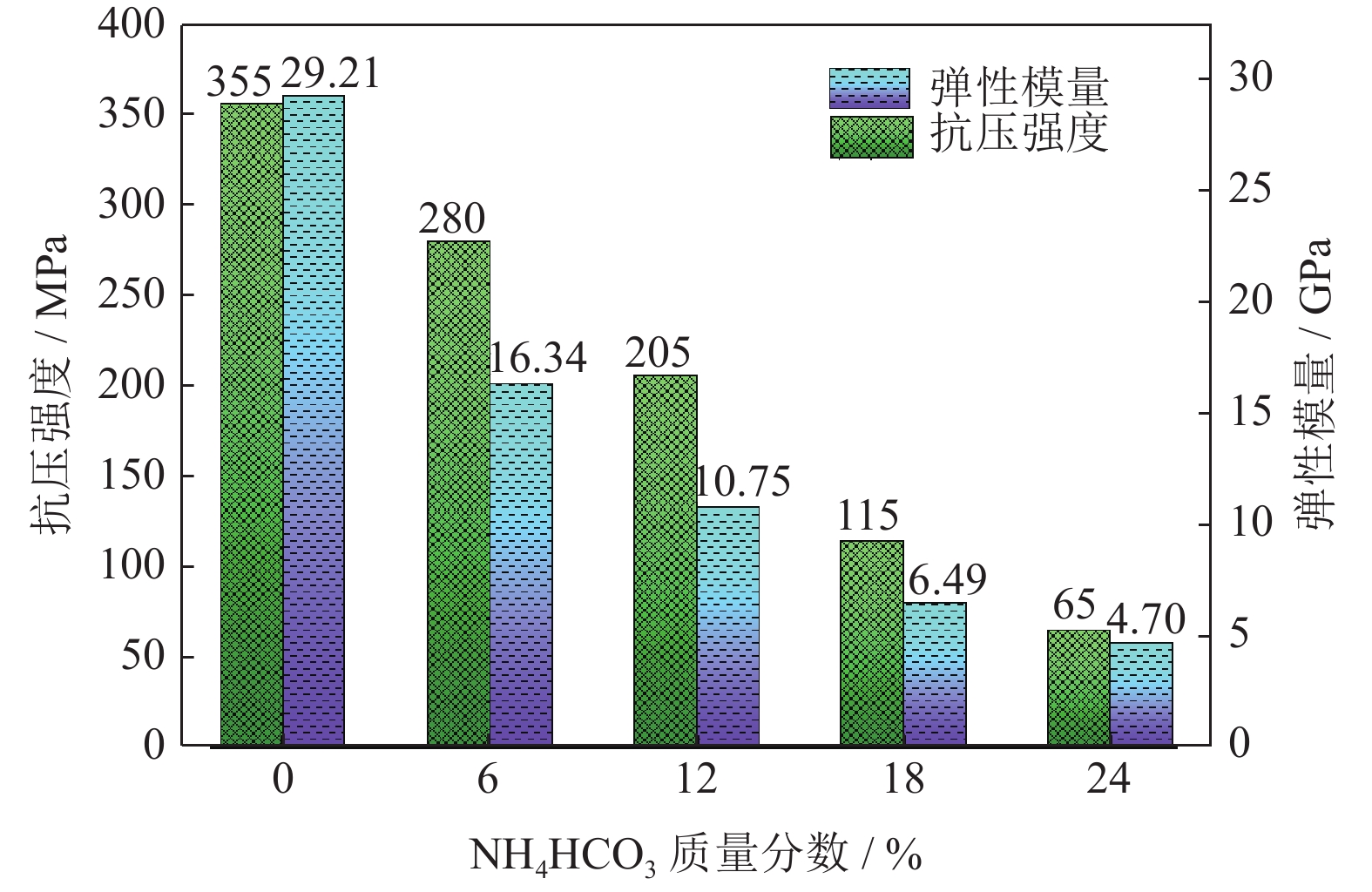
图13为添加不同质量分数NH4HCO3(粒径165~198 μm)对多孔Ti/16Mg复合材料力学性能的影响。由图13可知,随着NH4HCO3添加量由0增大到24%,多孔Ti/16Mg复合材料的抗压强度由355 MPa减小到65 MPa,弹性模量由29.21 GPa减小到4.70 GPa,说明复合材料的抗压强度和弹性模量与NH4HCO3添加量密切相关,且随着NH4HCO3添加量增加,多孔复合材料的抗压强度和弹性模量均有显著的降低,而NH4HCO3粒径的变化对多孔复合材料力学性能影响较小。人体骨一般分为皮质骨和松质骨,皮质骨的弹性模量为17~30 GPa,强度为100~230 MPa[39],松质骨的弹性模量为1~10 GPa,强度为3~20 MPa[40]。在本研究中可以观察到NH4HCO3添加量为0和6%时,抗压强度分别为355 MPa和280 MPa,弹性模量分别为29.21 GPa和16.34 GPa,强度过高,不符合人体植入物要求;当NH4HCO3添加量为12%时,抗压强度为10.75 GPa,弹性模量为205 MPa,适合作为人体骨植入物;当NH4HCO3添加量为18%和24%时,弹性模量分别为6.49 GPa和4.70 GPa,抗压强度分别为115 MPa和65 MPa,弹性模量较低,刚度较小,材料易发生变形,若植入人体,不足以支撑组织生长。从上述分析可知,随着NH4HCO3质量分数的提高,多孔Ti/16Mg复合材料的抗压强度逐渐减小,结合图12应力应变曲线中弹性变形阶段斜率的逐渐减小,即弹性模量降低。这是因为随着试样孔隙率的增加,试样不易维持连续的金属骨架结构,也不能支撑较大的压应力;与此同时,随着试样孔隙率的增加,在压缩过程中内部孔壁也较易塌陷,弹性变形阶段变短,斜率变小,即弹性模量减小。所以制备医用多孔Ti/16Mg复合材料需要合理调节造孔剂添加量与粒径,即选取质量分数为18%、粒径为165~198 μm的NH4HCO3,获得合适的孔径(100~500 μm)与孔隙率(约为33%)从而使得材料拥有优异的力学性能。
2.3 造孔剂对多孔Ti/16Mg复合材料耐腐蚀性能的影响
医用生物植入材料除了具有一定的力学性能支撑人体关节组织外,还需要具有一定的耐腐蚀性能[41]。由于植入材料在人体骨组织中与人体体液接触,发生降解以及电化学腐蚀,其产物释放会进入人体组织液中,影响人体内各种细胞的生物化学反应[19]。多孔Ti/16Mg复合材料中的Mg较易被腐蚀,使得植入材料在人体骨组织中的使用寿命缩短。实验采用三电极体系进行动电位极化扫描,测试多孔Ti/16Mg复合材料在人体模拟液中的耐腐蚀性。
2.3.1 造孔剂粒径对多孔Ti/16Mg复合材料耐腐蚀性能的影响
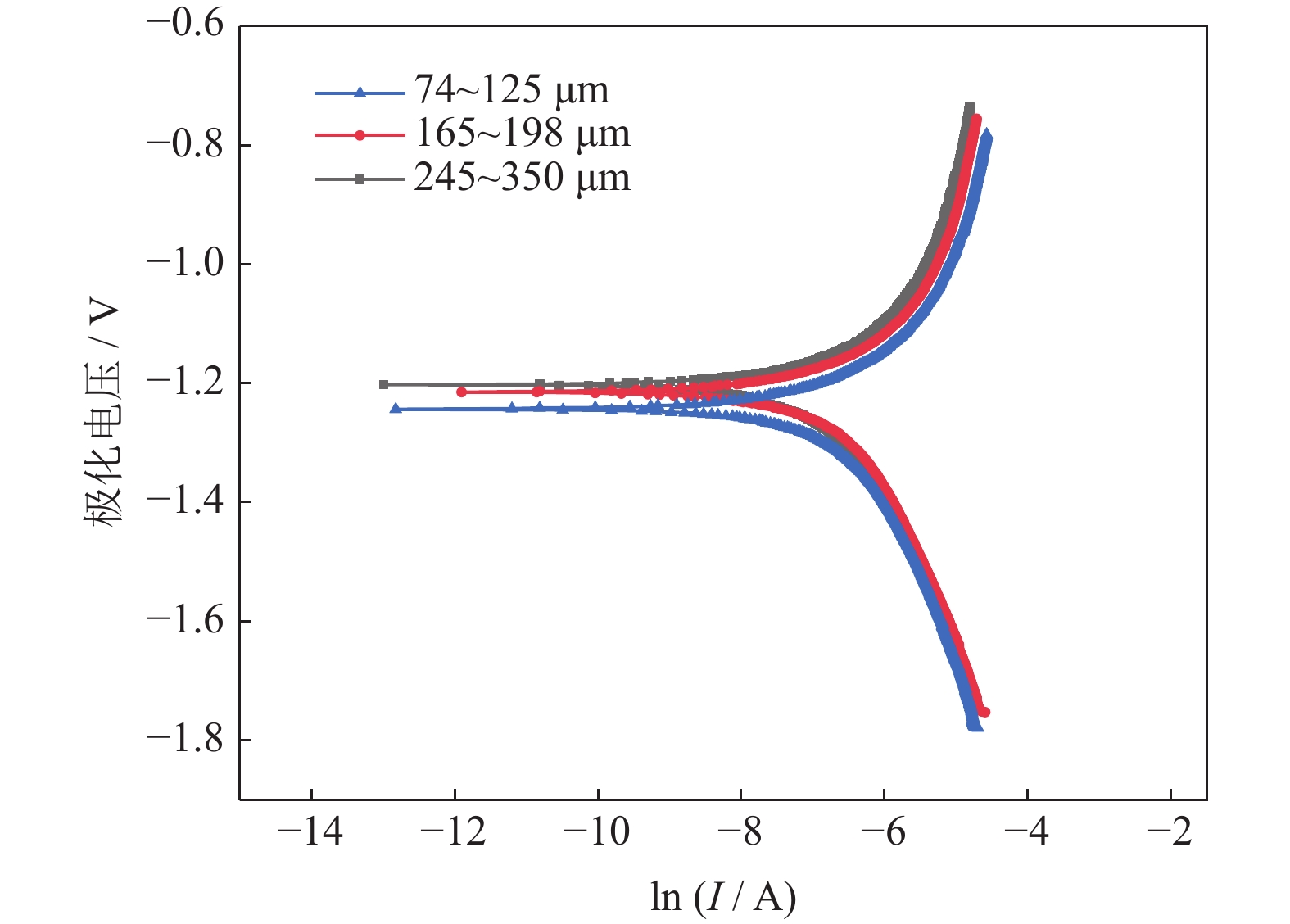
图14为添加不同粒径18%NH4HCO3制备的多孔Ti/16Mg复合材料动电位极化曲线,表3是对应的腐蚀电位、腐蚀电流及极化电阻等数据。由图可知,不同粒径NH4HCO3制备的多孔复合材料动电位极化曲线形状基本类似,没有明显的钝化区域,说明多孔复合材料的耐腐蚀性不强。当NH4HCO3粒径分别为245~350、165~198和74~125 μm时,其腐蚀电流密度分别为110.922、84.073和57.754 μA/cm2,极化电阻值分别为244.333、245.445和239.125 Ω·cm‒2,极化电阻变化幅度小于3%,说明NH4HCO3粒径的变化不会导致多孔复合材料的耐腐蚀性产生明显变化。
表 3 添加不同粒径18%NH4HCO3制备的多孔Ti/16Mg复合材料动电位极化曲线计算结果Table 3. Calculation results of potentiodynamic polarization curves for the porous Ti/16Mg composites added by 18%NH4HCO3 in different particle sizes粒径 / μm Ecorr / mV Icorr /
(μA·cm‒2)βa / mV βc / mV Rp /
(Ω·cm‒2)74~125 ‒ 1239 57.754 35.906 278.525 239.125 165~198 ‒ 1214 84.073 67.081 162.996 245.445 245~350 ‒ 1200 110.922 89.081 208.516 244.333 2.3.2 造孔剂添加量(质量分数)对多孔Ti/16Mg复合材料耐腐蚀性能的影响
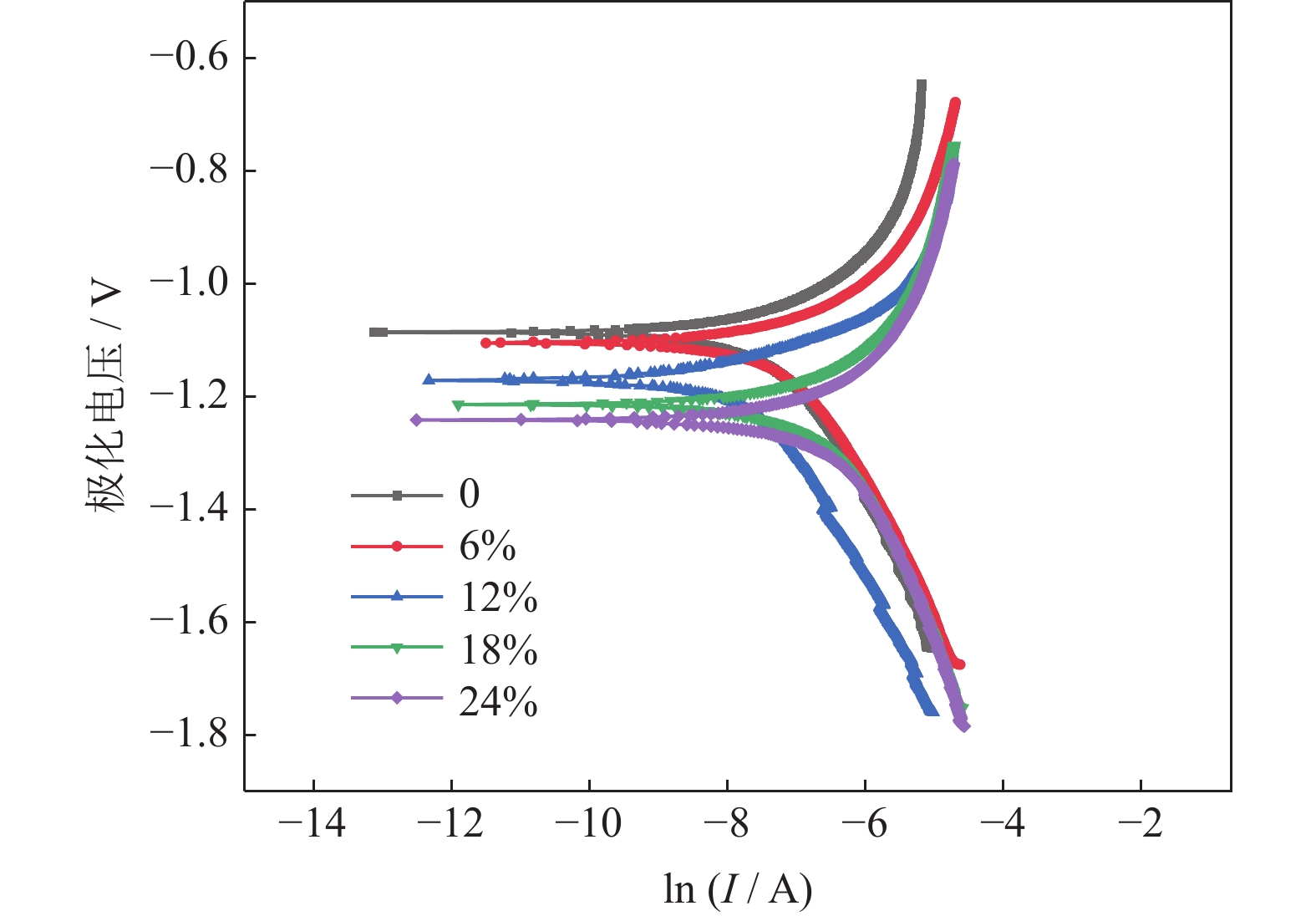
图15为添加不同质量分数NH4HCO3(粒径165~198 μm)制备的多孔Ti/16Mg复合材料动电位极化曲线,表4是对应的腐蚀电位、腐蚀电流及极化电阻等数据。由图可知,NH4HCO3添加量不同,多孔Ti/16Mg复合材料的动电位极化曲线形状类似。由图15结合表4可知,随着NH4HCO3添加量增加,多孔Ti/16Mg复合材料的极化电阻由574.528 Ω·cm‒2下降到139.236 Ω·cm‒2,下降幅度为75.77%,说明随着NH4HCO3添加量增加,多孔Ti/16Mg复合材料的耐腐蚀性略有下降。分析认为,NH4HCO3质量分数提高导致多孔Ti/16Mg复合材料的孔隙率增加,进而导致多孔复合材料与人体模拟液的接触面积增大,最终导致复合材料的耐腐蚀性有所下降。
表 4 添加不同质量分数NH4HCO3制备的多孔Ti/16Mg复合材料动电位极化曲线计算结果Table 4. Calculation results of potentiodynamic polarization curves for the porous Ti/16Mg composites added by NH4HCO3 in different mass fractionNH4HCO3
质量分数 / %Ecorr / mV Icorr /
(μA·cm‒2)βa / mV βc / mV Rp /
(Ω·cm‒2)0 ‒ 1084 73.991 193.133 198.543 574.528 6 ‒ 1112 94.770 194.859 210.694 464.324 12 ‒ 1198 45.360 46.224 126.581 324.125 18 ‒ 1214 84.073 67.081 162.996 245.445 24 ‒ 1242 38.859 13.101 254.945 139.236 3. 结论
(1)多孔Ti/16Mg复合材料物相组成主要是Ti相和Mg相,未有新相生成,说明采用NH4HCO3作为造孔剂不会对多孔Ti/16Mg复合材料的物相组成产生明显影响。添加不同粒径NH4HCO3制备出的多孔Ti/16Mg复合材料孔隙大小不一,但孔隙率接近,约为33%,孔洞贯通且多为椭圆形孔,其孔隙结构适合用作人体植入材料。
(2)不同粒径NH4HCO3对复合材料抗压强度和弹性模量的影响很小;在相同粒径条件下,造孔剂NH4HCO3质量分数由0增加到24%,多孔Ti/16Mg复合材料的抗压强度由355 MPa减小到65 MPa,弹性模量由29.21 GPa减小到4.70 GPa。当NH4HCO3质量分数为18%、粒径为165~198 μm时,弹性模量为6.49 GPa,抗压强度为115 MPa,与人体骨的弹性模量及抗压强度相匹配,在人体硬组织植入方面具有较好的应用前景。
(3)在人体模拟液中测量试样耐腐蚀性,添加不同粒径NH4HCO3的Ti/16Mg复合材料极化曲线整体变化趋势相似,其极化电阻随粒径减小由244.333 Ω·cm‒2变化为239.125 Ω·cm‒2,变幅小于3%,说明NH4HCO3粒径对复合材料的耐腐蚀性影响不大。在相同粒径条件下,随NH4HCO3质量分数由0增加至24%,试样极化电阻由574.528 Ω·cm‒2下降到139.236 Ω·cm‒2,降幅为75.77%,复合材料的耐腐蚀性能略有下降。
-
表 1 钛、镁粉末中元素化学成分(质量分数)
Table 1 Chemical composition of the Ti and Mg powders
% 粉末 Fe Al C N Si V Mn Cu Cl Ni Pb Ti粉 ≤0.02 ≤0.01 ≤0.01 ≤0.01 ≤0.01 ≤0.02 ≤0.01 — — — — Mg粉 ≤0.02 ≤0.02 — — ≤0.01 — ≤0.01 ≤0.01 ≤0.01 ≤0.01 ≤0.01 表 2 人体模拟液配方
Table 2 Formula of the simulated body fluid
g·L‒1 NaCl NaHCO3 KCl K2HPO4·3H2O MgCl2·6H2O CaCl2 Na2SO4 (CH2OH)3CNH2 8.035 0.355 0.255 0.231 0.311 0.292 0.072 6.118 表 3 添加不同粒径18%NH4HCO3制备的多孔Ti/16Mg复合材料动电位极化曲线计算结果
Table 3 Calculation results of potentiodynamic polarization curves for the porous Ti/16Mg composites added by 18%NH4HCO3 in different particle sizes
粒径 / μm Ecorr / mV Icorr /
(μA·cm‒2)βa / mV βc / mV Rp /
(Ω·cm‒2)74~125 ‒ 1239 57.754 35.906 278.525 239.125 165~198 ‒ 1214 84.073 67.081 162.996 245.445 245~350 ‒ 1200 110.922 89.081 208.516 244.333 表 4 添加不同质量分数NH4HCO3制备的多孔Ti/16Mg复合材料动电位极化曲线计算结果
Table 4 Calculation results of potentiodynamic polarization curves for the porous Ti/16Mg composites added by NH4HCO3 in different mass fraction
NH4HCO3
质量分数 / %Ecorr / mV Icorr /
(μA·cm‒2)βa / mV βc / mV Rp /
(Ω·cm‒2)0 ‒ 1084 73.991 193.133 198.543 574.528 6 ‒ 1112 94.770 194.859 210.694 464.324 12 ‒ 1198 45.360 46.224 126.581 324.125 18 ‒ 1214 84.073 67.081 162.996 245.445 24 ‒ 1242 38.859 13.101 254.945 139.236 -
[1] 杨芳, 李延丽, 申承秀, 等. 钛及钛合金粉末制备与成形工艺研究进展. 粉末冶金技术, 2023, 41(4): 330 Yang F, Li Y L, Shen C X, et al. Research progress on preparation and forming of titanium and titanium alloy powders. Powder Metall Technol, 2023, 41(4): 330
[2] 张永涛, 刘汉源, 王昌, 等. 生物医用金属材料的研究应用现状及发展趋势. 热加工工艺, 2017, 46(4): 21 Zhang Y T, Liu H Y, Wang C, et al. Development trend and research application situation of biomedical metal materials. Hot Working Technol, 2017, 46(4): 21
[3] 崔振铎, 朱家民, 姜辉, 等. Ti及钛合金表面改性在生物医用领域的研究进展. 金属学报, 2022, 58(7): 837 Cui Z D, Zhu J M, Jiang H, et al. Research progress of the surface modification of titanium and titanium alloys for biomedical application. Acta Mater Compos Sin, 2022, 58(7): 837
[4] 王运锋, 何蕾, 郭薇. 医用钛合金的研究及应用现状. 钛工业进展, 2015, 32(1): 1 Wang Y F, He L, Guo W. Research and application of medical titanium alloy. Titanium Ind Prog, 2015, 32(1): 1
[5] 郭佳明, 梁精龙, 沈海涛, 等. 生物医用钛合金材料制备方法及应用进展. 热加工工艺, 2021, 50(20): 30 Guo J M, Liang J L , Shen H T, et al. Preparation methods and application progress of biomedical titanium alloy materials. Hot Working Technol, 2021, 50(20): 30
[6] Chen Y, Xu Z, Smith C, et al. Recent advances on the development of magnesium alloys for biodegradable implants. Acta Biomater, 2014, 10(11): 4561 DOI: 10.1016/j.actbio.2014.07.005
[7] Xu Z G, Smith C, Chen S, et al. Development and microstructural characterizations of Mg‒Zn‒Ca alloys for biomedical applications. Mater Sci Eng B, 2011, 176(20): 1660 DOI: 10.1016/j.mseb.2011.06.008
[8] Ryan G, Pandit A, Apatsidis D P. Fabrication methods of porous metals for use in orthopedic applications. Biomaterials, 2006, 27(13): 2651
[9] St-pieere J P, Gauthier M, Lefebvre L P, et al. Three-dimensional growth of differentiating MC3T3-E1 preosteoblasts on porous titanium scaffolds. Biomaterials, 2005, 26(35): 7319 DOI: 10.1016/j.biomaterials.2005.05.046
[10] Lu B X, Yang F, Zhou Y, et al. Preparation of powder metallurgy titanium alloy with bimodal structure of high mechanical properties. Rare Met Mater Eng, 2022, 51(4): 1152
[11] 沈宏飞, 尤德强, 张鹏, 等. 以NH4HCO3为造孔剂制备的多孔钛及其力学性能. 特种铸造及有色合金, 2016, 36(3): 291 Shen H F, You D Q, Zhang P, et al. Preparation of porous titanium with NH4HCO3 as a space holder by powder metallurgy and its mechanical properties. Spec Cas Nonferrous Alloys, 2016, 36(3): 291
[12] 谢蒙优, 石建军, 陈国平, 等. 微波烧结技术的研究进展及展望. 粉末冶金工业, 2019, 29(3): 66 Xie M Y, Shi J J, Chen G P, et al. Research progress and prospect of microwave sintering technology. Powder Metall Ind, 2019, 29(3): 66
[13] 廖益龙. 微波烧结技术在Ti基复合材料制备中应用研究. 科学技术创新, 2021(26): 71 DOI: 10.3969/j.issn.1673-1328.2021.26.032 Liao Y L. Study on application of microwave sintering technology in preparation of Ti-matrix composites. Innov Sci Technol, 2021(26): 71 DOI: 10.3969/j.issn.1673-1328.2021.26.032
[14] 亢宁宁, 陈文革, 侯蕊, 等. 微波烧结与传统烧结对纯钛组织与性能的影响. 粉末冶金技术, 2019, 37(1): 50 Kang N N, Chen W G, Hou R, et al. Effects of microwave sintering and conventional sintering on microstructures and properties of pure titanium. Powder Metall Technol, 2019, 37(1): 50
[15] 王瑞虎, 杨军, 邹德宁, 等. 金属材料微波烧结技术的研究进展. 材料导报, 2021, 35(23): 23153 Wang R H, Yang J, Zou D N, et al. Recent progress on microwave sintering of metal materials. Mater Rep, 2021, 35(23): 23153
[16] 王飞, 周新贵, 余金山, 等. 微波烧结工艺制备陶瓷材料的研究现状. 材料导报, 2011, 25(19): 28 Wang F, Zhou X G, Yu J S, et al. Development of microwave sintering of ceramic materials. Mater Rev, 2011, 25(19): 28
[17] 周晓璐, 张帅, 李伟, 等. 造孔剂法制备新型多孔Ti‒Nb‒Ta‒Mo‒Zr合金. 热加工工艺, 2015, 44(16): 89 Zhou X L, Zhang S, Li W, et al. Porous Ti‒Nb‒Ta‒Mo‒Zr alloy for biomedical application fabricated by pore former method. Hot Working Technol, 2015, 44(16): 89
[18] 许莹, 王欢欢, 王变. 医用多孔β钛合金的制备方法研究进展. 钛工业进展, 2018, 35(3): 1 Xu Y, Wang H H, Wang B. Research progress in preparation methods of porous β-titanium alloy for medical use. Titanium Ind Prog, 2018, 35(3): 1
[19] 王巧. 生物医用多孔Ti‒Mg复合材料的微波烧结制备及降解行为研究[学位论文]. 南昌: 南昌航空大学, 2016 Wang Q. Degradation Behavior of Biomedical Porous Ti‒Mg Composites Prepared by Microwave Sintered [Dissertation]. Nanchang: Nanchang Hangkong University, 2016
[20] Wang Y Q, Tao J, Zhang J L. Effects of addition of NH4HCO3 on pore characteristics and compressive properties of porous Ti‒10%Mg composites. Trans Nonferrous Met Soc China, 2011, 21(5): 1074 DOI: 10.1016/S1003-6326(11)60824-8
[21] Xiong J Y, Li Y C, Wang X J, et al. Mechanical properties and bioactive surface modification via alkali-heat treatment of a porous Ti‒18Nb‒4Sn alloy for biomedical applications. Acta Biomater, 2008, 4(6): 1963 DOI: 10.1016/j.actbio.2008.04.022
[22] 梁丹丹, 王德志, 王小鹰, 等. 医用Ti‒Mo合金的制备及性能分析. 稀有金属材料与工程, 2013, 42(12): 2607 Liang D D, Wang D Z, Wang X Y, et al. Preparation and characteristics of the medical Ti‒Mo alloys. Rare Met Mater Eng, 2013, 42(12): 2607
[23] 王玺涵, 李述军, 贾明途, 等. 多孔医用Ti‒24Nb‒4Zr‒8Sn合金的制备和力学性能. 材料研究学报, 2010, 24(4): 378 Wang X H, Li S J, Jia M T, et al. Fabrication and mechanical properties of porous Ti‒24Nb‒4Zr‒8Sn alloy for biomedical applications. Chin J Mater Res, 2010, 24(4): 378
[24] Oliveira C S S D, Griza S, Oliveira M V D, et al. Study of the porous Ti35Nb alloy processing parameters for implant applications. Powder Technol, 2015, 281: 91 DOI: 10.1016/j.powtec.2015.03.014
[25] 王建忠, 敖庆波, 荆鹏, 等. 多孔钛的制备及应用. 稀有金属材料与工程, 2022, 51(5): 1907 Wang J Z, Ao Q B, Jing P, et al. Preparation and application of porous titanium. Rare Met Mater Eng, 2022, 51(5): 1907
[26] 尤力, 宋西平. 轧制及退火对Ti‒18Nb‒4Sn合金织构的影响. 金属学报, 2008, 44(11): 1310 DOI: 10.3321/j.issn:0412-1961.2008.11.006 You L, Song X P. Effects of rolling and annealing on the texture of Ti‒18Nb‒4Sn alloy. Acta Metall Sin, 2008, 44(11): 1310 DOI: 10.3321/j.issn:0412-1961.2008.11.006
[27] 李浩, 高岩, 袁斌, 等. 超弹性多孔β相Ti16Nb4Sn合金的制备及其性能. 机械工程材料, 2010, 34(3): 41 Li H, Gao Y, Yuan B, et al. Preparation and properties of superelastic porous β-phase Ti16Nb4Sn alloy. Mater Mech Eng, 2010, 34(3): 41
[28] 李毓轩, 崔振铎, 杨贤金, 等. 多孔Ti‒Nb‒Zr合金的孔隙特征与力学性能. 功能材料, 2011, 42(S1): 92 Li Y X, Cui Z Z, Yang X J, et al. Pores characteristics and mechanical properties of porous Ti‒Nb‒Zr alloy. J Funct Mater, 2011, 42(S1): 92
[29] 董晓蓉, 左孝青, 钟子龙, 等. 医用多孔Ni‒Ti形状记忆合金的制备和性能研究进展. 材料导报, 2014, 28(3): 71 Dong X R, Zuo X Q, Zhong Z L, et al. Research progress on preparation and properties of biomedical porous Ni‒Ti shape memory alloys. Mater Rev, 2014, 28(3): 71
[30] 麦萍, 崔旭梅, 赵朝勇, 等. 烧结工艺对多孔Ti‒5Cu合金微观结构和力学性能的影响. 钢铁钒钛, 2019, 40(3): 46 Mai P, Cui X M, Zhao C Y, et al. Effect of sintering process on microstructure and mechanical properties of porous Ti‒5Cu alloy. Iron Steel Vanadium Titanium, 2019, 40(3): 46
[31] 王月勤. 低模量多孔Ti‒Mg系生物复合材料的制备与性能研究[学位论文]. 南京: 南京航空航天大学, 2010 Wang Y Q. Preparation and Properties of Porous Ti‒Mg Matrix Bio-Composites with Low Elastic Modulus [Dissertation]. Nanjing: Nanjing University of Aeronautics and Astronautics, 2010
[32] 许莹, 王欢欢, 何世宇, 等. TiO2纳米管的制备及其性能研究. 钢铁钒钛, 2018, 39(4): 52 DOI: 10.7513/j.issn.1004-7638.2018.04.009 Xu Y, Wang H H, He S Y, et al. Preparation and properties of TiO2 nanotubes. Iron Steel Vanadium Titanium, 2018, 39(4): 52 DOI: 10.7513/j.issn.1004-7638.2018.04.009
[33] 王欢欢, 何世宇, 许莹, 等. 烧结温度对医用Ti‒29Nb‒4Mo‒13Ta‒9Zr合金性能的影响. 钢铁钒钛, 2018, 39(6): 48 DOI: 10.7513/j.issn.1004-7638.2018.06.007 Wang H H, He S Y, Xu Y, et al. Effect of sintering temperature on properties of Ti‒29Nb‒4Mo‒13Ta‒9Zr alloy for biomedical applications. Iron Steel Vanadium Titanium, 2018, 39(6): 48 DOI: 10.7513/j.issn.1004-7638.2018.06.007
[34] Kujala S, Ryhänen J, Danilova, et al. Effect of porosity on the osteointegration and bone ingrowth of a weight-bearing nickel-titanium bone graft substitute. Biomaterials, 2003, 24(25): 4691 DOI: 10.1016/S0142-9612(03)00359-4
[35] 赵朝勇, 张雪峰, 张磊, 等. 多孔Ti‒5Ag合金的制备及力学性能研究. 钢铁钒钛, 2018, 39(2): 49 DOI: 10.7513/j.issn.1004-7638.2018.02.008 Zhao C Y, Zhang X F, Zhang L, et al. Preparation and mechanical properties of porous Ti‒5Ag alloy. Iron Steel Vanadium Titanium, 2018, 39(2): 49 DOI: 10.7513/j.issn.1004-7638.2018.02.008
[36] 于振涛, 余森, 程军, 等. 新型医用钛合金材料的研发和应用现状. 金属学报, 2017, 53(10): 1238 DOI: 10.11900/0412.1961.2017.00288 Yu Z T, Yu S, Cheng J, et al. Development and application of novel biomedical titanium alloy materials. Acta Metall Sin, 2017, 53(10): 1238 DOI: 10.11900/0412.1961.2017.00288
[37] 张冬云, 胡松涛, 陈润平, 等. 3D打印Ti6Al4V多孔材料压缩性能. 北京工业大学学报, 2021, 47(11): 1275 DOI: 10.11936/bjutxb2020020016 Zhang D Y, Hu S T, Chen R P, et al. Compressive properties of 3d printed Ti6Al4V porous materials. J Beijing Univ Technol, 2021, 47(11): 1275 DOI: 10.11936/bjutxb2020020016
[38] 武秋池, 纪箴, 贾成厂, 等. 钛及钛合金人体植入材料研究进展. 粉末冶金技术, 2019, 37(3): 225 Wu Q C, Ji Z, Jia C C, et al. Research progress on titanium and titanium alloys used as implant materials for human body. Powder Metall Technol, 2019, 37(3): 225
[39] 李伯琼, 陆兴, 王德庆. 制备工艺对多孔钛的微观结构和压缩性能的影响. 大连铁道学院学报, 2006(3): 70 Li B Q, Lu X, Wang D Q. The effect of processing on microstructures and mechanical properties of porous titanium. J Dalian Jiaotong Univ, 2006(3): 70
[40] Wen C E, Mabuchi M, Yamada Y, et al. Processing of biocompatible porous Ti and Mg. Scr Mater, 2001(45): 1147
[41] 于振涛, 韩建业, 麻西群, 等. 生物医用钛合金材料的生物及力学相容性. 中国组织工程研究, 2013, 17(25): 4707 DOI: 10.3969/j.issn.2095-4344.2013.25.020 Yu Z T, Han J Y, Ma X Q, et al. Biological and mechanical compatibility of biomedical titanium alloy materials. Chin J Tissue Eng Res, 2013, 17(25): 4707 DOI: 10.3969/j.issn.2095-4344.2013.25.020



 下载:
下载: